"Кристаллы" - читать интересную книгу автора (Китайгородский Александр Исаакович)
14. Как растут кристаллы
Водяной пар, вода и лёд – это одно и то же вещество, молекулы которого состоят из 2-х атомов водорода и одного атома кислорода. Можно сказать про лёд, что это – твёрдая вода, или про воду, что это – жидкий лёд. Одно и то же вещество существует в трёх состояниях – газообразном, жидком и твёрдом. Вообще говоря, все вещества могут быть с большим или меньшим трудом получены во всех трёх состояних. Сталь и железо плавятся на металлургических заводах, жидкий воздух изготовляется для разных технических целей и развозится по городу в специальных теплоизолированных сосудах, твёрдый углекислый газ – это хорошо знакомый нам «сухой лёд»…
Почти любое вещество может при известных условиях дать кристаллы. Кристаллы можно получить из раствора или из расплава данного вещества, а также из его паров (например, чёрные ромбовидные кристаллы иода легко выпадают из его паров при нормальном давлении без промежуточного перехода в жидкое состояние).
Начните растворять в воде столовую соль или сахар. Не любое количество удастся растворить. При комнатной температуре (20°) вы сумеете растворить в гранёном стакане 70 граммов соли. Дальнейшие добавки соли растворяться не будут и улягутся на дне в виде осадка. Раствор, в котором дальнейшее растворение уже не идёт, называется
Представьте себе теперь, что вы приготовили насыщенный раствор, скажем, сахара при температуре 30° и начинаете охлаждать его до 20°. При 30° вы сможете растворить в 100 граммах воды 223 грамма сахара, при 20° растворяется 205 граммов. Тогда при охлаждении от 30 до 20° 18 граммов окажутся «лишними» и, как говорят, выпадут из раствора. Итак, один из возможных способов получения кристаллов состоит в охлаждении насыщенного раствора.
Можно поступить и иначе. Приготовьте насыщенный раствор соли и оставьте его в открытом стакане. Через некоторое время вы обнаружите появление кристалликов. Почему же они образовались? Внимательное наблюдение покажет, что одновременно с образованием кристаллов произошло ещё одно изменение – количество воды убыло. Вода испарилась, и в растворе оказалось «лишнее» вещество. Итак, другой возможный способ образования кристаллов – это испарение раствора.
Как же происходит образование кристаллов из раствора?
Мы сказали, что кристаллы «выпадают» из раствора; надо ли это понимать так, что неделю кристалла не было, а в одно какое-то мгновение он вдруг сразу возник? Нет, дело обстоит не так:
Не удаётся, разумеется, обнаружить глазом самые начальные моменты роста. Сначала немногие из беспорядочно движущихся молекул или атомов растворённого вещества собираются в том примерно порядке, который нужен для образования кристаллической решётки. Такую группу атомов или молекул называют зародышем.
Опыт показывает, что зародыши охотнее образуются при наличии в растворе каких-либо посторонних мельчайших пылинок. Всего быстрее и легче кристаллизация начинается тогда, когда в насыщенный раствор помещается маленький кристалл-затравка. При этом выделение из раствора твёрдого вещества будет заключаться не в образовании новых кристалликов, а в росте затравки.
Рост зародыша не отличается, конечно, от роста затравки. Смысл использования затравки состоит в том, что она «оттягивает» на себя выделяющееся вещество и препятствует, таким образом, одновременному образованию большого числа зародышей. Если же зародышей образуется сразу много, то они будут мешать друг другу при росте и не позволят нам получить крупных кристаллов.
Как распределяются на поверхности зародыша новые порции атомов или молекул, выделяющихся из раствора?
Опыт показывает, что рост зародыша или затравки заключается как бы в перемещении граней параллельно самим себе в направлении, перпендикулярном грани. При этом углы между гранями остаются постоянными. (Мы уже знаем, что постоянство углов – важнейший признак кристалла, вытекающий из его решетчатого строения.)
На рисунке 36[7] даны последовательные очертания трёх кристаллов одного и того же вещества при их росте. Подобную картину можно наблюдать в микроскоп. В случае, изображённом слева, число граней во время роста сохраняется. Средний рисунок даёт пример появления новой грани (вверху справа) и снова её исчезновения.
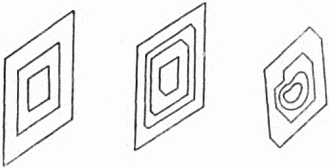 |
Рис. 36. Слева – рост кристалла с сохранением числа граней; в середине – грани по мере роста кристалла могут зарастать и появляться вновь; справа – обломок кристалла приобретает при росте правильную форму.
Очень важно отметить, что скорость роста граней, то есть скорость перемещения их параллельно самим себе, неодинакова у разных граней. При этом «зарастают» – исчезают именно те грани, которые перемещаются всего быстрее, например левая нижняя грань на среднем рисунке. Наоборот, медленно растущие грани оказываются самыми широкими, как говорят, наиболее развитыми.
Особенно отчётливо это видно на последнем рисунке. Бесформенный обломок приобретает ту же форму, что и другие кристаллы именно из-за анизотропии скорости роста. Вполне определённые грани развиваются за счёт других всего сильнее и придают кристаллу форму, свойственную всем образцам этого вещества.
Очень красивые переходные формы наблюдаются в том случае, когда в качестве затравки берётся шар, а раствор попеременно слегка охлаждается и нагревается. При нагревании раствор становится ненасыщенным, и идёт частичное растворение затравки. Охлаждение ведёт к насыщению раствора и росту затравки. Но молекулы оседают при этом по-иному, как бы отдавая предпочтение некоторым местам. Вещество, таким образом, переносится с одних мест шара на другие.
Сначала на поверхности шара появляются маленькие грани в форме кружков. Кружки постепенно увеличиваются и, соприкасаясь друг с другом, сливаются по прямым рёбрам. Шар превращается в многогранник. Затем одни грани обгоняют другие, часть граней зарастает, и кристалл приобретает свойственную ему форму (рис. 37).
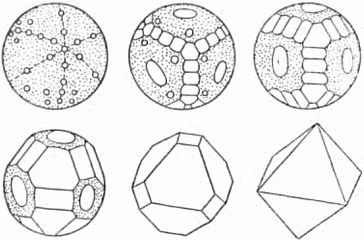 |
Рис. 37. Как кристаллический шар превращается в правильный октаэдр.
При наблюдении за ростом кристаллов поражает основная особенность роста – параллельное перемещение граней. Получается так, что выделяющееся вещество застраивает грань слоями; пока один слой не достроен, следующий строиться не начинает.
На рисунке 38 показана «недостроенная» упаковка атомов. В каком из обозначенных буквами положений прочнее всего будет удерживаться новый атом, пристроившись к кристаллу? Без сомнения, в
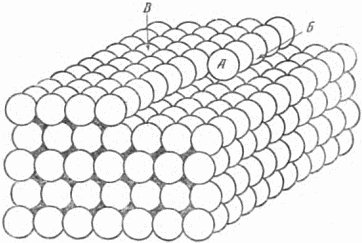 |
Рис. 38. Как растёт кристалл.
В целом ряде случаев кристаллы образуются из расплавленной массы – из
Начнём нагревать какое-нибудь кристаллическое вещество, например каменную соль. До 804° кристаллики каменной соли будут мало изменяться: они лишь незначительно расширяются, и вещество остаётся твёрдым.
Измеритель температуры, помещённый в сосуд с веществом, показывает непрерывный рост температуры при нагревании. При 804° мы обнаружим сразу два новых, связанных между собой явления: вещество начнёт плавиться, и подъём температуры приостановится. Пока всё вещество не превратится в жидкость, температура не изменится; дальнейший подъём температуры – это уже нагревание жидкости. Все кристаллические вещества имеют определённую
Как мы уже знаем, в каждом кристаллике атомы или молекулы вещества образуют упорядоченную упаковку и совершают малые колебания около своих средних положений. По мере нагревания тела скорость колеблющихся частиц возрастает вместе с размахом колебаний.
Это увеличение скорости движения частиц с возрастанием температуры составляет один из основных законов природы, который относится к веществу в любом состоянии – твёрдом, жидком или газообразном. Зная температуру, можно вычислить, с какой средней скоростью движутся частицы вещества. Скорости эти довольно велики – порядка нескольких сот метров в секунду. При нагревании тела, например от нуля до 1000°, скорость частиц возрастает более чем вдвое.
Когда достигнута определённая, достаточно высокая температура кристалла, колебания его частиц становятся столь энергичными, что аккуратное расположение частиц становится невозможным – кристалл плавится.
С началом плавления подводимое тепло идёт уже не на увеличение скорости частиц, а на разрушение кристаллической решётки. Поэтому подъём температуры приостанавливается. Последующее нагревание – это увеличение скорости частиц жидкости.
В интересующем нас случае кристаллизации из расплава явления наблюдаются в обратном порядке: по мере охлаждения жидкости её частицы замедляют своё хаотическое движение; при достижении определённой, достаточно низкой температуры скорость частиц уже столь мала, что некоторые из них под действием сил притяжения начинают пристраиваться одна к другой, образуя кристаллические зародыши. Пока всё вещество не закристаллизуется, температура остаётся постоянной. Эта температура, как правило, та же, что и температура плавления.
О том, как получить из твердеющего расплава крупные кристаллы, мы расскажем в следующей главе. Это не так просто.
Если не принимать специальных мер, то кристаллизация из расплава начнётся сразу во многих местах. Кристаллики будут расти в виде правильных, свойственных им многогранников совершенно так же, как мы это описывали выше. Однако свободный рост продолжается недолго: увеличиваясь, кристаллики наталкиваются друг на друга, в местах соприкосновения рост прекращается, и затвердевшее тело получает зернистое строение. Каждое зерно – это отдельный кристаллик, которому не удалось принять своей правильной формы.
В зависимости от многих условий и, прежде всего, от быстроты охлаждения твёрдое тело может обладать более или менее крупными зёрнами: чем медленнее охлаждение, тем крупнее зёрна. Размеры зёрен кристаллических тел колеблются от миллионной доли сантиметра до нескольких миллиметров. В большинстве случаев зернистое кристаллическое строение тел можно наблюдать в микроскоп. Твёрдые тела обычно имеют именно такое мелкокристаллическое строение.
| © 2024 Библиотека RealLib.org (support [a t] reallib.org) |