"Глаз, мозг, зрение" - читать интересную книгу автора (Хьюбел Дэвид Хантер)
5. Архитектура зрительной коры
По сравнению с наружными коленчатыми телами (НКТ) и сетчаткой первичная зрительная кора, или стриарная кора, — структура гораздо более сложная. Как мы уже видели, резкое увеличение структурной сложности отделов мозга сопровождается таким же усложнением физиологической организации. В стриарной коре мы находим большее разнообразие функциональных типов клеток. Нейроны стриарной коры отвечают на более сложные стимулы, т.е. стимулы с большим числом параметров, причем эти параметры должны быть вполне определенными. Если при исследовании клеток сетчатки и НКТ нам достаточно было изменять только местоположение и размеры стимула в виде простого пятна, то теперь мы внезапно столкнулись с необходимостью учитывать такие параметры, как ориентация линии, направление движения, длина линии и ее кривизна, а также выбор глаза, на который подается стимул. Какая связь существует между этими параметрами и структурной организацией коры (если она вообще есть)? Для того чтобы подойти к рассмотрению этого вопроса, сначала необходимо сообщить кое-что о строении стриарной коры.
Кора представляет собой слой нервной ткани толщиной около 2 мм, который почти полностью покрывает большие полушария головного мозга. Площадь поверхности коры у человека составляет больше квадратного фута (около 900 см2). Общая площадь коры у макаков примерно в 10 раз меньше, чем у человека. Уже более столетия известно, что кора полушарий подразделяется на множество различных
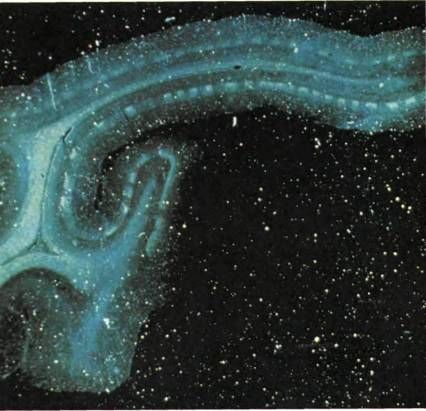 |
Рис. 60. На этом срезе видны колонки глазодоминантности в коре левого полушария мозга макака. Срез сделан перпендикулярно поверхности коры в направлении слева направо. Прослеживая поверхность коры в направлении слева направо (см. верхнюю часть фотографии), мы увидим, что она образует изгиб и глубокую складку, проходящую справа налево. Радиоактивная аминокислота, введенная путем инъекции в левый глаз животного, транспортировалась через НКТ в слой 4C коры и сосредоточилась во множестве отдельных участков толщиной каждый в полмиллиметра, которые выделяются как яркие полоски на общем темном фоне. (Сплошной светлый листок в середине — это белое вещество, состоящее из волокон от коленчатого тела.)
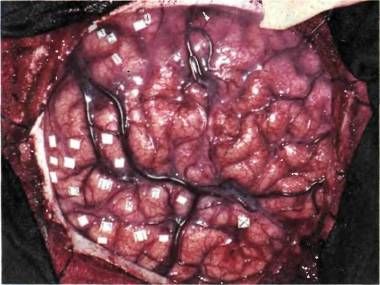 |
Рис. 61. Здесь видна значительная часть коры правого полушария головного мозга, открытая под местной анестезией для нейрохирургической операции по поводу эпилепсии. Больной находился в полном сознании. Операцию проводил хирург д-р У. Фейндел в Монреальском неврологическом институте. Участок скальпа был отвернут и соответствующий кусок черепа удален (временно, до окончания операции). На снимке видны борозды, извилины, крупные вены пурпурного оттенка и более мелкие (красного цвета) артерии. Общий розоватый оттенок открытой части мозга объясняется наличием мелкой сети разветвлений этих сосудов. Нижняя треть обнаженного участка — височная доля. Выше горизонтально идущих крупных вен расположены части теменной доли (слева) и лобной доли (справа). У самого левого края можно видеть полоску затылочной доли. Операция проводилась с целью лечения определенной формы эпилепсии и заключалась в удалении пораженной части мозга. Такая операция допускается лишь в том случае, если не может привести к нарушению произвольных движений или речи. Для того чтобы избежать этого, нейрохирург путем раздражения электрическим током идентифицирует области, связанные с речью, движениями и чувствительностью, выясняя, какие при этом возникают двигательные эффекты, ощущения в различных частях тела и нарушения речи. Ясно, что такие испытания были бы невозможны, если бы больной не был в сознании. Места, где производилось раздражение, отмечены кусочками стерильной бумаги с цифрами. При раздражении отмечались, например, такие результаты: 1) ощущение покалывания в большом пальце левой руки; 2) покалывание в безымянном пальце левой руки; 3) покалывание в безымянном и среднем пальцах левой руки; 4) сгибание пальцев левой руки и запястья. При раздражении участков с номерами 8 и 13 возникали более сложные явления, сходные с образами памяти, что бывает у некоторых больных эпилепсией при раздражении височной доли.
На рис. 62 представлена фотография мозга макака (вид сзади). Черепная коробка была удалена, а мозг с целью консервации перфузировали разбавленным раствором формальдегида, что придало ему желтую окраску. Обычно на поверхности коры бросается в глаза сеть кровеносных сосудов, однако здесь они находятся в спавшемся состоянии и поэтому незаметны. На этой фотографии видна главным образом поверхность затылочной доли коры, т.е. та область, которая имеет прямое отношение к зрению и включает не только стриарную кору, но также и одну-две дюжины (а может быть, и больше)
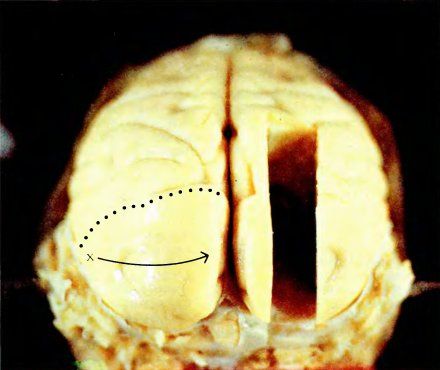 |
Рис. 62. Мозг макака (вид сзади). Показана затылочная доля и часть стриарной коры, выходящая на поверхность этой доли (ниже пунктирной линии).
Область на фотографии, лежащая позади (ниже) пунктирной линии, — это открытая, видимая часть стриарной коры. Хотя стриарная кора занимает бо́льшую часть поверхности затылочной доли, на фото мы можем увидеть только часть ее (0,3–0,5 всей площади); остальная часть скрыта в борозде.
Стриарная кора (поле 17) имеет множество выходных волокон, значительная часть которых идет в следующую корковую область —
На той же фотографии буквой X обозначен тот участок поля 17, который получает входные сигналы от центральных ямок обеих сетчаток. Если двигаться по левому полушарию из точки X в направлении, указанном стрелкой, то в поле зрения это будет соответствовать движению объекта по горизонтали от точки фиксации. Если же, выйдя снова из точки X, двигаться прямо вдоль границы между полями 17 и 18, то это будет соответствовать движению объекта от точки фиксации вниз, а перемещение в обратном направлении — движению объекта вверх. Самой стрелке в поле зрения соответствует горизонтальная линия длиной около 6°. Области поля зрения, расположенные дальше 9° от центра взора, отображаются в ту часть поля 17, которая лежит в складке коркового слоя под наружной поверхностью мозга, параллельно ей.
Для того чтобы посмотреть, как выглядит кора в поперечном разрезе, мы вырезали участок зрительной коры из правой половины мозга, изображенного на рис. 62. Полученный срез был обработан крезиловым фиолетовым, который окрашивает тела нейронов в синий цвет, но не окрашивает аксоны и дендриты. На этой микрофотографии, сделанной при малом увеличении, нельзя различить отдельные клетки, но можно видеть темные слои плотно упакованных клеток и более светлые слои, где клеток гораздо меньше. Под наружной поверхностью коры видна сложная структура из складок, напоминающая по форме гриб. В действительности эта структура и поверхностная часть коры без перерыва переходят друг в друга. Светлоокрашенное пространство — это белое вещество, оно заполняет области между наружными частями коры и ее глубже расположенными складками. Белое вещество состоит в основном из миелинизированных нервных волокон, которые не окрашиваются красителем. Часть коры, содержащая тела нервных клеток, их аксоны и дендриты, а также синапсы, образует серое вещество.
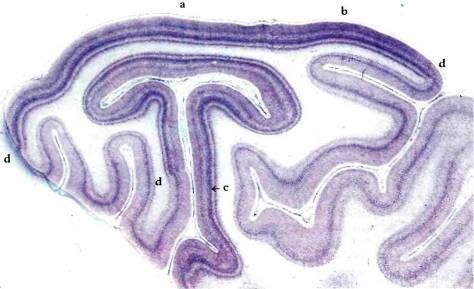 |
Рис. 63. Срез затылочной доли мозга (из участка, показанного на рис. 62): он соответствует левой стенке канавки, вырезанной в правом полушарии). Буквой
По сложности своей слоистой структуры поле 17 превосходит все другие зоны коры. Эту разницу можно заметить даже при малом увеличении (рис. 63), если сравнить поле 17 и соседнюю область справа — поле 18 (граница между ними отмечена буквой
На рис. 64 представлен небольшой участок поля 17 при более сильном увеличении. Здесь уже можно различить в виде точек тела отдельных клеток и получить некоторое представление об их размерах, количестве и распределении. Видимая картина слоев частично определяется интенсивностью окрашивания клеток и частично — плотностью их упаковки. Слои 4C и 6 — самые плотные и темные. В слоях 1, 4B и 5 клетки расположены наиболее рыхло. Слой 1 едва ли содержит хотя бы одну нервную клетку, но здесь множество аксонов, дендритов и синапсов. Для того чтобы показать, что разные слои включают разные типы клеток, нужно применить какой-либо вариант методики, изобретенной в 1900 году К. Гольджи. При окраске по Гольджи выявляются лишь немногие клетки, зато на срезах клетка видна вся целиком, включая ее аксон и дендриты. Два главных класса корковых клеток — это пирамидные клетки, имеющиеся во всех слоях коры, кроме слоев 1 и 4, и звездчатые клетки, которые есть во всех слоях. Примеры пирамидной и звездчатой клеток представлены на рис. 4. Типичное распределение пирамидных клеток в коре показано на рисунке Рамон-и-Кахала, помещенном в его книге «Гистология» (рис. 65); здесь изображена лишь небольшая доля всех пирамидных клеток, имеющихся в этом участке, наверное около 1 процента.
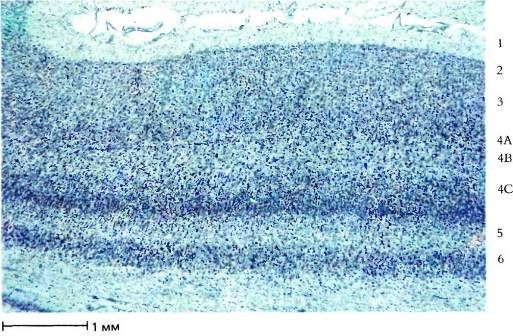 |
Рис. 64. Поперечный срез стриарной коры при большем увеличении. Видны клетки, расположенные слоями. Слои 2 и 3 невозможно отграничить друг от друга; слой 4A очень тонок. Толстый светлый слой внизу — белое вещество.
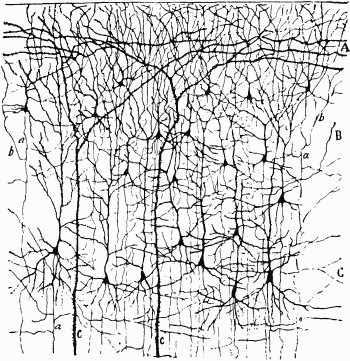 |
Рис. 65. Окрашенный по Гольджи срез слоев 1, 2 и 3 зрительной коры младенца в возрасте нескольких дней. Черные треугольнички — тела клеток, от которых отходят апикальные дендриты, поднимающиеся вверх и разветвляющиеся в слое 1, базальные дендриты, идущие в боковых направлениях, и один тонкий аксон, направляющийся прямо вниз.
Волокна, идущие из НКТ, приходят в кору из белого вещества мозга. Пройдя в диагональном направлении, большая часть волокон доходит до слоя 4C, многократно разветвляется и, наконец, достигает конечного пункта, образуя синапсы со звездчатыми клетками, которые в основном заполняют этот слой. Аксоны, выходящие их двух вентральных (крупноклеточных) слоев НКТ, оканчиваются в верхней половине слоя 4C, называемой подслоем 4Cα, a те, которые выходят из четырех дорсальных (мелкоклеточных) слоев НКТ, оканчиваются в нижней половине слоя 4C (подслой 4Cβ). Как видно из схемы на рис. 66, эти два подслоя образуют разные проекции в верхних слоях — 4Cα посылает сигналы в 4B, а 4Cβ — в слои 2 и 3. Последние в свою очередь тоже различаются по своим проекциям. Заметное различие в нервных путях, выходящих из двух групп слоев НКТ, — это одно из многих оснований предполагать, что с этими путями связаны две разные системы. У большинства пирамидных клеток в слоях 2, 3, 4B, 5 и 6 аксоны выходят из коры, однако у этих аксонов есть ответвления (коллатерали), которые образуют локальные связи и таким образом помогают распределить информацию по всей толще коры.
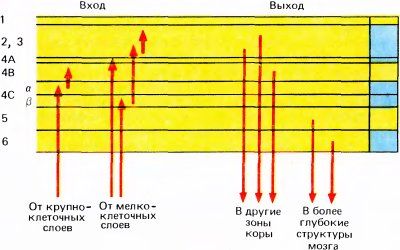 |
Рис. 66. Главные пути от HKT к стриарной коре и от стриарной коры к другим областям мозга. В правой части схемы отмечены зоны с наибольшей плотностью окраски по Нисслю (для сравнения с рис. 64).
Корковые слои различаются не только своими входами и внутренними связями, но также и адресами тех структур, куда они проецируются. Все они, кроме слоев 1, 4A и 4C, имеют выходные волокна, уходящие за пределы коры. Верхние слои 2 и 3, а также слой 4B посылают сигналы главным образом в другие области коры, тогда как нижние слои проецируются на подкорковые структуры: из слоя 5 выходные волокна идут в средний мозг, в верхние бугорки четверохолмия, а из слоя 6 волокна направляются обратно в НКТ. Хотя уже почти столетие известен тот факт, что выходные волокна НКТ идут в основном в корковый слой 4, мы ничего не знали о различиях между выходами разных слоев коры, пора в 1969 году японский исследователь К. Тояма не обнаружил впервые эти различия в физиологических экспериментах. С тех пор эти данные были многократно подтверждены морфологическими методами.
Рамон-и-Кахал был первым, кто понял, насколько коротки внутренние связи в коре. Как уже говорилось, наиболее многочисленные связи идут вверх и вниз, тесно объединяя разные слои. Диагональные и боковые (горизонтальные) связи обычно имеют длину от 1 до 2 мм, хотя некоторые связи прослеживаются на расстояние 4–5 мм. Такое ограничение «горизонтальной» передачи информации в коре приводит к важным последствиям. Если входы организованы по топографическому принципу (в случае зрительной системы — в соответствии с положением отображаемой точки на сетчатке или в поле зрения), то этот же принцип должен сохраняться и в организации выходов. Какие бы функции ни выполняла кора, проводимый анализ должен быть локальным. Информация о любом небольшом участке поля зрения поступает в какой-то небольшой участок коры, где подвергается преобразованию, анализу, переработке (назовите это как угодно) и передается куда-нибудь для дальнейшей обработки независимо от того, что происходит с информацией о соседнем участке. Таким образом, изображение зрительной сцены анализируется как бы мозаично. Поэтому первичная зрительная кора не может быть тем местом, где распознаются, воспринимаются или подвергаются другой обработке целые объекты, например лодки, шляпы, лица, т.е. не может быть субстратом процессов «восприятия». Разумеется, столь общий вывод вряд ли правомерно делать на основе одних только анатомических данных: ведь информация могла бы передаваться на большие расстояния вдоль коры и по принципу эстафеты, с отдельными этапами по одному миллиметру. Однако, регистрируя активность клеток при одновременной стимуляции сетчатки, можно показать, что дело обстоит не так: выясняется, что все клетки в данном небольшом участке имеют маленькие рецептивные поля и что соседние клетки всегда имеют рецептивные поля, расположенные почти в одном и том же месте. Нет никаких физиологических данных, которые указывали бы на то, что какая-либо клетка в первичной зрительной коре обезьяны соединена с какой-то другой клеткой на расстоянии больше 2–3 миллиметров.
На «мозаичный» характер обработки информации давно уже указывают и данные клинической неврологии. После небольших инсультов, опухолей или ранений первичной зрительной коры может наступать полная слепота в небольших, четко ограниченных участках поля зрения. При этом во всех остальных участках сохраняется нормальное зрение. Если бы каждая клетка была в какой-то мере связана со всеми другими, то вместо этого можно было бы ожидать некоторого общего, нелокального ухудшения зрения. Отойдя несколько в сторону от нашей темы, следует заметить, что больные с такими поражениями могут и не осознавать наличия у них дефекта поля зрения, особенно в тех случаях, когда не затронута та часть коры, где находится проекция центральной ямки сетчатки, т.е. точки фиксации взора. Во всяком случае, такие больные не видят в поле зрения ни сплошь черных или сплошь серых островков, ни каких-либо других дефектов. Даже если разрушена вся затылочная доля на одной стороне и человек ничего не видит в противоположной половине поля зрения, то у него не возникает впечатления, что с этой стороны зрительный мир от него закрыт. У меня самого иногда бывают приступы мигрени (к счастью, без головной боли) с кратковременной слепотой, нередко в значительной части одного из полуполей зрения. Если спросить,
Еще одна любопытная особенность, наблюдаемая у больных с островком локальной слепоты, или
Сходным образом, если смотреть на большой лист белой бумаги, то в коре будут возбуждаться только те клетки, рецептивные поля которых попадают на край этого листа (поскольку корковые клетки имеют склонность игнорировать равномерно распределенный свет). В этом случае прекращение активности клеток, рецептивные поля которых целиком лежат в пределах листа бумаги, должно приводить к исчезновению различий яркости в этой области поля зрения. Островок слепоты в данном случае не должен быть виден — и он не виден. Мы не можем увидеть свое слепое пятно в виде черного отверстия в листе белой бумаги, на которую смотрим. Феномен заполнения, проявляющийся в опыте с листом бумаги, должен убедить каждого в том, что, исходя из одних только интуитивных представлений, мы не сможем понять, как работает на самом деле мозг.
Теперь мы можем вернуться к исходному вопросу: как связаны между собой физиологические свойства корковых клеток и их структурная организация? Можно еще больше заострить этот вопрос: зная, что корковые клетки могут различаться по положению их рецептивных полей, «сложности», предпочитаемой ориентации стимула, глазодоминантности, по оптимальному направлению движения стимула и оптимальной длине стимульной линии, правомерно ли ожидать, что соседние клетки сходны по некоторым из этих параметров или даже по всем? Или же клетки с разными свойствами просто рассыпаны по всей коре случайным образом, без всякой связи с их физиологическими свойствами?
Если изучать анатомию коры невооруженным глазом или под микроскопом, это мало что даст. На поперечных срезах можно увидеть отчетливые различия между отдельными слоями коры. Однако если прослеживать на поперечном срезе тот же слой по длине или же изучать срезы одного слоя, сделанные параллельно границе слоев, то мы увидим один лишь серый однородный материал. Хотя такая однородность может указывать на случайное распределение клеток, мы знаем, что по крайней мере в отношении одной переменной клетки расположены весьма упорядоченно. Речь идет о закономерном соответствии между распределением клеток в стриарной коре и положением их рецептивных полей на сетчатке, т.е. о том, что соседние клетки коры должны иметь рецептивные поля, расположенные близко друг к другу в поле зрения. Именно такая картина выявляется в экспериментах. У двух клеток, лежащих рядом в коре, рецептивные поля обычно даже перекрываются на большей части своей площади. Тем не менее эти поля не накладываются точно друг на друга. Если сдвигать микроэлектрод вдоль коры от клетки к клетке, то положения соответствующих рецептивных полей сдвигаются в направлении, которое можно предсказать, зная топографию отображения сетчатки в коре. Никто не усомнился бы в таком результате и 50 лет назад, имея данные о связях НКТ с корой и о случаях локальной слепоты после инсультов. Но как обстоит дело с остальными параметрами — глазодоминантностью, «сложностью», ориентацией адекватных стимулов и другими?
Потребовалось несколько лет для того, чтобы научиться достаточно надежно стимулировать корковые клетки и регистрировать их ответы; в результате появилась возможность описывать реакции не только отдельных клеток, но и сравнительно больших групп нейронов. Началось с того, что нам случайно удалось одновременно записать ответы двух или нескольких клеток (пример такой записи был приведен на рис. 59). Записать ответ двух соседних клеток несложно. В тех экспериментах, где мы определяли предпочитаемый клеткой стимул, мы почти всегда использовали внеклеточное отведение, помещая кончик микроэлектрода рядом с клеткой; в этом случае регистрировались не изменения мембранного потенциала, а токи, связанные с импульсами. Часто при этом оказывалось, что мы регистрируем реакции не одной, а нескольких клеток одновременно — скажем, в том случае, когда кончик микроэлектрода останавливался на полпути между двумя телами нейронов. Импульсные разряды одиночных клеток при таком отведении почти идентичны, однако величина и форма импульсов зависят от расстояния и от взаимного расположения клеток, так что разряды, отводимые одновременно от двух клеток, обычно оказываются разными, и поэтому их можно легко различить. Выполняя такого рода отведения от двух клеток, мы смогли отчетливо увидеть, чем различаются соседние клетки и в чем они одинаковы.
В одном из первых таких отведений были обнаружены две корковые клетки, отвечавшие на противоположные движения руки, которой махали перед животным. В этом случае две лежавшие бок о бок клетки давали разные (по существу, противоположные) реакции на движение стимула. Однако в других отношениях эти клетки почти наверное проявляли сходные свойства. Если бы я в 1956 году был уже подготовлен к изучению ориентационной избирательности, то я, весьма вероятно, обнаружил бы, что обе предпочитаемые ориентации близки к вертикальной, так как данные клетки хорошо отвечали на горизонтальные движения стимула. Тот факт, что обе они реагировали на возвратно-поступательное движение руки, означает, что положения рецептивных полей этих клеток приблизительно совпадали. Если бы я исследовал эти нейроны на глазодоминантность, то скорее всего этот параметр тоже оказался бы одинаковым.
Уже в первых записях активности корковых нейронов нас поразило то, как часто две клетки, реакции которых можно регистрировать одновременно, одинаковы по глазодоминантности, сложности и, что самое удивительное, по оптимальной ориентации стимулов. Такие совпадения, вряд ли случайные, позволяют предположить, что клетки с одними и теми же свойствами объединены в группы. Возможность такой группировки весьма заинтересовала нас, и как только это предположение подтвердилось, мы стали выяснять, каковы размеры и форма этих групп.
С помощью микроэлектродов можно исследовать только отдельные точки коры. Для того чтобы получить представление о трехмерной организации мозга, приходится медленно погружать электрод в глубину, время от времени останавливать его для записи активности какой-нибудь клетки (а возможно, — двух или трех клеток), отмечать по специальной шкале показания глубины, а затем повторять все сначала. Рано или поздно кончик микроэлектрода пройдет через весь корковый слой, и тогда электрод можно вынуть и снова ввести его в каком-нибудь другом месте. После окончания эксперимента делают срез, окрашивают его и исследуют под микроскопом с целью определить положение каждой из нервных клеток, активность которых регистрировалась. В одном эксперименте длительностью около 24 часов обычно удается сделать две-три проходки примерно по 4–5 миллиметров каждая. За одну проходку можно наблюдать ответы примерно 200 клеток.
Микроэлектрод настолько тонок, что едва удается найти след от его прохождения под микроскопом, поэтому нет оснований думать, что при проходке микроэлектродом будет повреждено много клеток и это может повлиять на реакции близлежащих нейронов. Вначале нам было трудно находить на гистологическом срезе след от микроэлектрода, не говоря уже о том, чтобы определить положение кончика электрода, и это затрудняло оценку положения тех клеток, активность которых была записана. Эту трудность удалось преодолеть, когда было обнаружено, что пропускание через микроэлектрод слабого тока приводит к разрушению клеток в ближайшей окрестности кончика микроэлектрода, и на гистологических срезах эта зона разрушения хорошо видна. К счастью, при пропускании тока сам микроэлектрод не повреждается. Поэтому за одну проходку ток пропускают 3–4 раза, отмечая при этом глубину погружения микроэлектрода, а так как глубину отмечают и при регистрации активности клеток, то можно оценить и положение каждой из них. Разумеется, при воздействии тока погибает несколько клеток около кончика микроэлектрода, однако их не так много, чтобы могла быть нарушена работа более удаленных нейронов. Для того чтобы при этом не исказить ответы клеток, лежащих впереди на пути микроэлектрода, его кончик немного продвигают вперед, регистрируют активность клеток, а затем кончик отводят назад и тогда уже пропускают ток.
Как и следовало ожидать, клетки во входном корковом слое — слое 4 — проявляют более простое поведение, чем клетки на выходе. Мы уже отмечали в этой главе, что у обезьяны клетки в слое 4Cβ, куда приходят волокна из четырех верхних (мелкоклеточных) слоев НКТ, по-видимому, не обладают избирательностью к ориентации стимула и ведут себя подобно клеткам, имеющим круглые рецептивные поля с центром и периферией. В слое 4Cα, имеющем входы от двух вентральных (крупноклеточных) слоев НКТ, некоторые клетки обладают круглыми полями с центром и периферией, а всем остальным, видимо, свойственны простые рецептивные поля и ориентационная чувствительность. Если перейти к следующему уровню — к слоям, лежащим выше и ниже слоя 4C, — то подавляющее большинство клеток окажутся сложными. Клетки, реагирующие на концы линий, в слоях 2 и 3 составляют около 20 процентов, а в других слоях встречаются редко. Таким образом, в целом обнаруживается явная корреляция между сложностью клеток и положением их в зрительном пути, которое можно оценить по числу синаптических переключений до данного места.
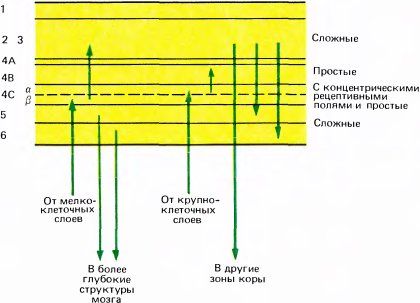 |
Рис. 67. Примерная схема размещения клеток физиологически различного типа в разных слоях стриарной коры.
В утверждении, что большинство клеток выше и ниже слоя 4 — сложные, упускаются из виду существенные различия между слоями: сложные клетки здесь далеко не одинаковы. Разумеется, все они имеют одно общее свойство, характерное для сложных клеток, — на движущуюся линию оптимальной ориентации они отвечают по всему рецептивному полю, независимо от конкретного положения стимула. Однако они различаются между собой другими свойствами. Можно выделить четыре подтипа клеток, которые содержатся в основном в разных слоях. Большинство сложных клеток в слоях 2 и 3 отвечает тем лучше, чем длиннее стимульная линия (в этом проявляется свойство
Подводя итоги, можно сказать, что при переходе от слоя к слою в поведении клеток выявляются более важные различия, чем, скажем, различия в оптимальной ориентации стимула или же в характере глазодоминантности. Наиболее заметные различия между клетками разных корковых слоев касаются сложности их реакций; это отражает тот простой анатомический факт, что одни слои расположены ближе к входу в кору, чем другие.
Группы клеток стриарной коры с различной глазодоминантностью были обнаружены раньше всего, так как они довольно крупные. Разработано много методов исследования таких группировок, поэтому они сейчас лучше всего изучены. Уже в самом начале исследований на коре обезьян стало очевидно, что всякий раз, когда микроэлектрод входит в кору перпендикулярно ее поверхности, он встречает одну за другой клетки, лучше реагирующие на стимуляцию одного и того же глаза (это показано на рис. 68). Если микроэлектрод вынуть и ввести его в другом месте в нескольких миллиметрах от предыдущего, то снова для всех встречающихся клеток доминирующим будет один глаз — тот же, что и раньше, или другой. В слое 4C, имеющем входы непосредственно от НКТ, доминирование одного глаза становится уже не относительным, а абсолютным, монопольным. В тех же слоях, которые расположены выше и ниже и, следовательно, находятся дальше в цепи синаптических переключений, более половины всех клеток могут возбуждаться и от недоминирующего глаза. Такие клетки мы называем
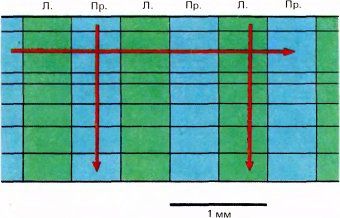 |
Рис. 68. Глазодоминантность остается неизменной при вертикальном продвижении микроэлектрода в стриарной коре. Если же электрод продвигается параллельно поверхности коры, то зоны с различной глазодоминантностью чередуются, причем каждая пара таких зон занимает около 1 мм.
Если вместо того, чтобы перемещать электрод перпендикулярно поверхности коры, мы вводили его с наклоном, как можно ближе к линии, параллельной поверхности, то клетки с разной глазодоминантностью чередовались — доминирующим был то один глаз, то другой. Полный цикл этой смены соответствовал примерно одному миллиметру. Очевидно, если бы можно было видеть структуру коры сверху, она представлялась бы мозаикой, составленной из чередующихся зон с доминированием правого и левого глаза.
Чем обусловлено такое чередование, стало ясно, когда был разработан новый метод окраски, позволяющий прослеживать ветвление отдельных аксонов, приходящих из НКТ, и распределение их окончаний в коре. Ветвление одного аксона таково, что тысячи его концевых синапсов образуют в слое 4C два или три скопления шириной 0,5 мм, разделенных промежутками около 0,5 мм, как показано на рис. 69. Поскольку клетки НКТ монокулярные, каждый отдельный аксон связан в конечном счете либо с правым, либо с левым глазом. Предположим, что аксон, изображенный на рис. 69 слева, относится к волокнам от левого глаза; в этом случае каждое входящее в тот же участок коры волокно, связанное с левым глазом, будет разветвляться в тех же скоплениях окончаний величиной 0,5 мм каждое. Промежутки между этими скоплениями размером тоже 0,5 мм будут заняты концевыми разветвлениями волокон от правого глаза. Такой особый тип распределения аксонов из НКТ в слое 4C сразу позволяет объяснить строгую монокулярность клеток в этом слое.
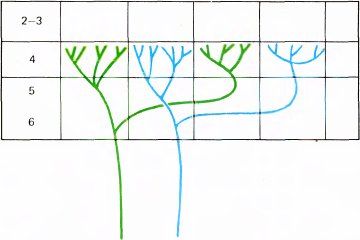 |
Рис. 69. Каждый аксон из HKT сначала проходит в стриарной коре через нижние слои, последовательно ветвится и затем оканчивается в слое 4C. Здесь он образует скопления синаптических окончаний шириной 0,5 мм, отделенные друг от друга промежутками такой же ширины. Все волокна от одного глаза группируются в одних и тех же участках. В промежутках между этими участками группируются волокна от другого глаза. Область разветвлений одного волокна из крупноклеточного слоя HKT может составлять от 2 до 3 мм (окончания находятся в слое 4Cα). Волокно из мелкоклеточного слоя HKT ветвится в более ограниченной области (в слое 4Cβ), обычно занимающей лишь одну или две колонки.
Для того чтобы избирательно окрашивать одно и только одно волокно, требовался новый метод, и он был предложен в конце 1970-х годов. Этот метод основан на использовании аксонного транспорта — процесса, в результате которого различные материалы (белки или даже более крупные частицы) непрерывно переносятся в обоих направлениях внутри аксона. Некоторые из них транспортируются со скоростью нескольких сантиметров в час, другие — несколько миллиметров в сутки. Для того чтобы окрасить одиночный аксон, с помощью микропипетки вводят в него вещество, о котором известно, что оно переносится по аксону и окрашивает его, но не влияет на структуру клетки. В настоящее время чаще всего используют фермент пероксидазу из хрена. Этот фермент распространяется по аксону в обоих направлениях и катализирует химическую реакцию, продукт которой очень эффективно окрашивает клетку. Поскольку фермент служит катализатором, достаточно ничтожных его количеств, чтобы получить интенсивную окраску. Важно и то, что в самой нервной ткани фермента с подобными свойствами нет: это исключает возможность нежелательной окраски фона.
Тот факт, что кора разбита на колонки глазодоминантности, проходящие от поверхности мозга вплоть до белого вещества, подтвердил морфологические данные о том, что группы клеток в слое 4C служат главными местами передачи зрительной информации в клеточные слои, лежащие выше и ниже этого слоя. Наличие некоторого числа горизонтальных и диагональных связей длиной около миллиметра, идущих по всем направлениям, должно приводить к некоторому размыванию четких зон доминирования правого или левого глаза в слоях, расположенных выше и ниже слоя 4C (рис. 70). Поэтому можно ожидать, что клетка, расположенная прямо над центром зоны доминирования левого глаза в слое 4, будет явно лучше отвечать на стимуляцию этого глаза (а возможно, и полностью контролироваться им), тогда как клетка, расположенная ближе к границе между участками разной глазодоминантности, может оказаться бинокулярной без какого-либо доминирования одного из глаз. Действительно, при горизонтальном передвижении электрода в верхнем слое коры или же в слое 5 или 6 отмечаются постепенные изменения глазодоминантности: сначала будут встречаться клетки, намного сильнее активируемые одним глазом, затем клетки, у которых эта асимметрия выражена слабее, потом клетки с равной зависимостью от обоих глаз, после чего начнет усиливаться влияние другого глаза. Такие плавные переходы резко контрастируют с той внезапной сменой глазодоминантности, которую мы наблюдаем при движении электрода вдоль слоя 4C (рис. 71).
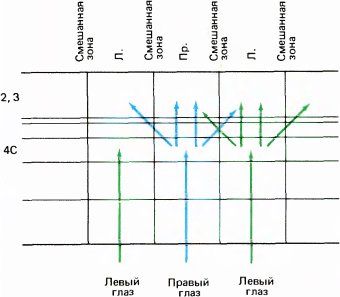 |
Рис. 70. Из-за наличия горизонтальных и диагональных связей выше слоя 4 происходит перекрывание колонок глазодоминантности и границы их размываются.
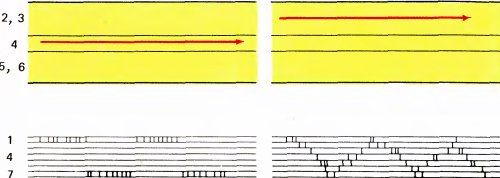 |
Рис. 71. В отличие от четких границ между колонками глазодоминантности в слое 4 коры, границы колонок в верхних (2 и 3) и нижних (5 и 6) слоях коры размыты. Стрелками показано направление продвижения микроэлектрода в слое 4 (вверху слева) и в слое 2 или 3 (вверху справа). Внизу представлена глазодоминантность клеток, ответы которых регистрировались в одной проходке микроэлектрода. В слое 4 видны резкие переходы от группы 1 (влияет только контралатеральный глаз) к группе 7 (влияет только ипсилатеральный глаз). В других слоях встречается много бинокулярных клеток, а глазодоминантность периодически изменяется, проходя через промежуточные уровни (цифры 1, 4 и 7 означают категории клеток по глазодоминантности).
Если смотреть «сбоку», две совокупности клеток в слое 4C выглядят как чередующиеся участки. Однако нам хотелось узнать, как будет выглядеть распределение этих участков при взгляде на поверхность коры сверху. Допустим, что они отмечены на поверхности коры черным или белым цветом. С точки зрения топологии можно распределить эти участки несколькими разными способами: в шахматном порядке, в виде чередующихся черных и белых полос, в виде черных пятен на белом фоне или использовать любые комбинации этих паттернов. На рис. 72 показаны три возможных варианта такого распределения. Решать поставленную задачу с помощью одних только микроэлектродов означает использовать одномерные средства для расшифровки неизвестной трехмерной структуры. Это задача безнадежная — все равно что пытаться подстричь траву на лужайке с помощью ножниц для ногтей. Столкнувшись с такими трудностями, многие предпочли бы переключиться на совершенно иной вид деятельности — заняться, скажем, сельским хозяйством или юриспруденцией. (В начале 1960-х годов, когда Торстен Визел и я были более терпеливыми и решительными, чем сейчас, мы действительно попытались выяснить топографию глазодоминантности с помощью микроэлектродов, и нам удалось даже получить кое-какие результаты. Образно выражаясь, я в те дни действительно пытался подстричь травяной газон ножницами, так как мы не могли позволить себе купить газонокосилку. В то время мы были беднее, чем нынешние аспиранты, однако были, вероятно, более настойчивыми.)
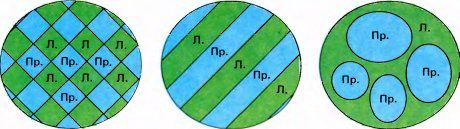 |
Рис. 72. Здесь показаны три возможных способа разбиения поверхности на два вида областей — разбиение в виде шахматной доски, в виде полос и в виде островков. В данном случае речь идет о поверхности коры и зонах доминирования правого или левого глаза.
К счастью, в последние десять лет были придуманы очень эффективные методы нейроморфологических исследований, и сейчас поставленная нами задача уже решена независимо несколькими способами; два из них описаны ниже.
Первый способ опять-таки основан на использовании аксонного транспорта. Берут небольшое количество органического вещества (например, аминокислоты́), меченного радиоактивным изотопом (например, 14C), и инъецируют в один глаз обезьяны, скажем в левый. Вещество захватывается клетками глаза, в том числе и ганглиозными клетками сетчатки. Помеченные молекулы, по-видимому уже включенные в состав белков, переносятся по аксонам ганглиозных клеток и их окончаниям в НКТ. Здесь они накапливаются в слоях, связанных с левым глазом. Для переноса метки требуется несколько дней. Затем из ткани приготовляют тонкие срезы, накладывают на них фотоэмульсию и оставляют на несколько дней в темноте. В результате получается радиоавтограф вроде показанного на рис. 73, где можно увидеть в каждом из двух НКТ по три слоя, связанных с левым глазом. Черные области, где образовались зерна, в одном НКТ расположены так, как светлые области в другом.
 |
Рис. 73. На этих срезах наружных коленчатых тел — левого и правого — можно видеть концентрацию радиоактивной метки в трех слоях, связанных с левым глазом. За неделю до получения срезов в левый глаз был введен пролин, меченный тритием. Те слои, в которых накопилась метка, выглядят на радиоавтографе темными и более толстыми.
Для того чтобы наблюдать такую картину организации НКТ, нужно ввести в глаз не так много радиоактивного вещества. Если же при инъекции ввести его в достаточно большом количестве, то концентрация его в слоях НКТ станет настолько высокой, что часть радиоактивной метки перейдет из окончаний волокон зрительного нерва в клетки самих НКТ (в пределах меченых слоев) и будет транспортироваться по
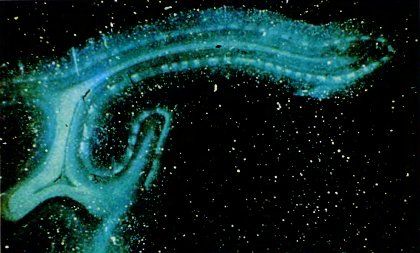 |
Рис. 74. На этом радиоавтографе среза стриарной коры светлые участки соответствуют тем местам в слое 4, где накопилось много радиоактивного вещества после инъекции его в левый глаз животного. Эти участки разделены темными зонами, не содержащими радиоактивной метки, — зонами доминирования правого глаза.
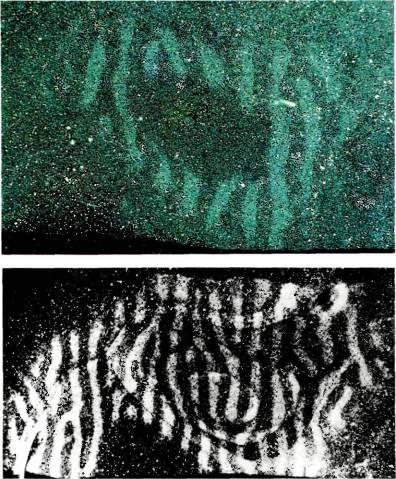 |
Рис. 75.
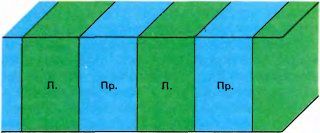 |
Рис. 76. В объемном представлении колонки глазодоминантности больше похожи не на греческие колонны, а на ломтики нарезанного хлеба, расположенные перпендикулярно поверхности.
Используя другой способ, С. Ле-Вэй успешно осуществил реконструкцию вида всей стриарной коры в затылочной доле. Участок коры, лежащий на поверхности мозга, показан на рис. 77. Распределение полос оказалось наиболее регулярным и четким на некотором расстоянии от корковой проекции центральной ямки. Вблизи этой проекции узор по неизвестным причинам наиболее сложен — он отличается регулярностью, но содержит много петель и завитков, поэтому он здесь мало похож на тот правильный узор, напоминающий рисунок обоев, который характерен для областей коры, более удаленных от проекции центральной ямки. Ширина полосок везде постоянна и равна примерно 0,5 мм. В процентном отношении корковые представительства правого и левого глаза примерно равны, пока речь идет о проекции центральной области сетчатки диаметром около 40°. Ле-Вэй и Д. ван Эссен обнаружили, что за пределами этой области из-за уменьшения вклада ипсилатерального глаза соответствующие ему полоски сужаются до 0,25 мм. Если же говорить о проекции зоны, удаленной от центральной ямки на 70–80°, то здесь, разумеется, представлен только ипсилатеральный глаз. Это естественно, так как поле зрения правого глаза простирается вправо дальше, чем влево.
 |
Рис. 77. Здесь показан результат реконструкции зон глазодоминантности по Ле-Вэю (часть поля 17 правого полушария).
Второй метод изучения колонок глазодоминантности позволяет выявлять их во всей толще коры, а не только в слое 4. Это метод с использованием меченой 2-дезоксиглюкозы, изобретенный в 1976 году Л. Соколоффом в Национальных институтах здоровья в Бетезде. Он тоже основан на способности радиоактивных веществ засвечивать фотопленку. В основе его лежит тот факт, что нейроны, как и большинство других клеток организма, поглощают глюкозу в качестве источника энергии, и чем интенсивнее им приходится работать, тем больше глюкозы они потребляют. Поэтому можно было бы представить себе следующую процедуру. Животному впрыскивают радиоактивную глюкозу, а затем стимулируют один глаз, например правый, в течение нескольких минут предъявляя какую-либо фигуру (время стимуляции должно быть достаточным для того, чтобы возбужденные клетки в мозгу поглотили введенную глюкозу). После этого мозг извлекают, делают срезы и покрывают их фотоэмульсией, а затем после надлежащей экспозиции получают, как и в предыдущем случае, радиоавтограф. Однако на самом деле такая схема не годится, так как глюкоза, поглощенная клетками, расщепляется с образованием продуктов, которые быстро переходят обратно в кровь. Для того чтобы предотвратить эту утечку, Соколофф предложил остроумный прием — использовать при инъекции дезоксиглюкозу, которая по химической структуре очень близка к обычной глюкозе. «Обманутые» клетки поглощают ее и даже пытаются расщеплять; однако этот процесс прерывается после первого же шага; дезоксиглюкоза превращается в 2-дезоксиглюкозо-6-фосфат, который далее не может быть расщеплен. К счастью, это вещество нерастворимо в липидах клеточной мембраны и поэтому не может выйти из клетки. Оно накапливается в клетке в таком количестве, что уже может быть обнаружено с помощью радиоавтографии. Рассматривая результат этой процедуры — радиоавтограф, можно получить представление о том, какие участки мозга были наиболее активны в период стимуляции и накопили больше всего этой «фальшивой глюкозы». Если бы в ходе опыта животное делало движения лапой, то на радиоавтографе выявился бы также соответствующий участок моторной зоны коры. То, что мы видим после стимуляции правого глаза, — это та часть вещества коры, которая была в наибольшей степени возбуждена данным стимулом, а именно набор колонок глазодоминантности для правого глаза. Примеры получаемых результатов представлены на рис. 78.
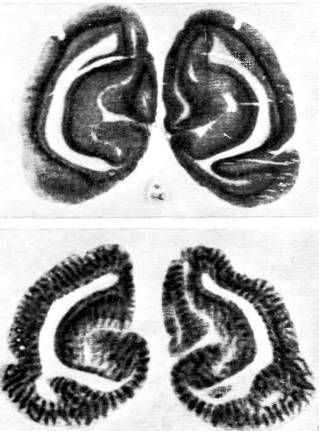 |
Рис. 78. Результаты двух экспериментов с радиоактивной дезоксиглюкозой.
Идею того же метода исследования удачно развил Р. Тутелл из лаборатории Рассела де Валуа в Беркли, взяв в качестве стимула для животного, смотревшего на экран одним глазом, большую фигуру в виде концентрических окружностей и радиальных линий (рис. 79, вверху). Получившаяся в результате картина корковой проекции тоже содержала круги и радиусы, но только в искаженном виде, что связано с неодинаковым увеличением разных участков сетчатки в их проекции на стриарную кору (с этим же связано и различие в остроте зрения на периферии сетчатки и в центральной ямке). Кроме того, каждая из окружностей и каждый из радиусов разбиты на множество мелких участков, соответствующих колонкам глазодоминантности. При одновременной стимуляции обоих глаз полосы были бы непрерывными. Редко так бывает, что в одном эксперименте удается столь четко продемонстрировать сразу несколько важных фактов.
 |
Рис. 79. В этом эксперименте, проведенном Р. Тутеллом, в центре поля зрения наркотизированного макака в течение 45 мин предъявляли стимул, напоминающий мишень с несколькими радиальными линиями. Предварительно животному была сделана инъекция радиоактивной 2-дезоксиглюкозы. Один глаз был закрыт. В нижней части рисунка показано распределение метки в стриарной коре левого полушария мозга. На этом радиоавтографе представлен срез коры, параллельный ее поверхности. Перед тем как сделать срез, корковую ткань растянули и заморозили. Полукруглые линии стимула отображаются в коре как почти вертикальные линии, а радиальные линии правой части зрительного поля — в виде горизонтальных линий. «Пунктирный» характер каждой линии на радиоавтографе обусловлен тем, что в опыте стимулировался только один глаз и, значит, возбуждались только соответствующие колонки глазодоминантности.
Колонки глазодоминантности есть у кошек, некоторых низших обезьян, шимпанзе и человека. У грызунов и тупайи их нет. У саймири (род обезьян Нового Света) некоторые указания на возможное существование таких колонок получены в физиологических экспериментах, но современные методы морфологического анализа не выявляют их. В настоящее время нам неизвестна роль этого сложного распределения сигналов, приходящих от разных глаз; возможно, что оно имеет какое-то отношение к стереоскопическому зрению.
Подразделение на участки с функционально специализированными клетками было обнаружено не только в стриарной коре. Впервые такие участки описал в середине 1960-х годов В. Маунткасл в соматосенсорной коре. Это явилось наиболее важным открытием с того времени, когда были получены первые сведения о локализации функций мозга. Соматосенсорная область коры имеет такое же отношение к осязанию и проприоцепции, как стриарная кора — к зрению. Маунткасл показал, что эта область подразделяется на вертикально ориентированные зоны, внутри которых клетки чувствительны к прикосновению, и зоны, в которых клетки отвечают на сгибание в суставах или на приложение значительного давления к конечности. Так же как и в случае колонок глазодоминантности, ширина этих зон составляет примерно 0,5 мм. Однако еще не ясно, образуют ли эти зоны полосы, шахматный рисунок или же отдельные островки на общем фоне. Маунткасл назвал их
Регистрируя реакции нейронов стриарной коры, мы уже в самом начале заметили, что всякий раз, когда одновременно отводится активность двух клеток, эти клетки оказываются сходными не только по глазодоминантности, но и по оптимальной ориентации стимула. Возникает вопрос: однотипны ли соседние клетки и по всем другим свойствам? Ответ будет отрицательным. Как я уже упоминал, положения рецептивных полей в большинстве случаев не вполне совпадают, хотя поля обычно перекрываются; дирекциональная чувствительность часто бывает противоположной, или же у одной клетки она может быть хорошо выражена, а у другой ее может не быть вовсе. В слоях 2 и 3, где встречаются клетки, реагирующие на концы линий, одна клетка может не проявлять совсем этого свойства, а соседняя — обладать им в полной мере. С другой стороны, две соседние клетки очень редко обнаруживают явное различие в оптимальной ориентации стимула или противоположную глазодоминантность.
Предпочитаемая ориентация, так же как и глазодоминантность, остается неизменной при прохождении электрода вертикально сквозь всю толщу коры. Как уже говорилось, в слое 4Cβ клетки вообще не обладают избирательностью к ориентации стимула; но как только мы доходим до слоя 5, у клеток выявляется сильно выраженная настройка на определенную ориентацию, причем оптимальная ориентация здесь та же, что была выше слоя 4. Если теперь вынуть электрод и ввести его в каком-нибудь другом месте, то общая картина останется прежней, только ориентация скорее всего будет уже другой. Таким образом, кора разбита на узкие участки с постоянной предпочтительной ориентацией, которые идут от поверхности коры до белого вещества, но прерываются в слое 4, где клетки не обладают ориентационной избирательностью.
Если же, наоборот, вводить электрод параллельно поверхности коры, то наблюдается удивительно закономерное изменение предпочитаемой ориентации — каждый раз, когда электрод перемещается на 0,05 мм (50 мкм), ориентация сдвигается в среднем на 10° по часовой стрелке или против часовой стрелки. Поэтому при продвижении электрода на 1 мм она обычно меняется на противоположную. Величины 50 мкм и 10° близки к пределу доступной ныне точности измерений, так что нельзя сказать определенно, меняется ли ориентация при смещении электрода непрерывно или же сдвигается скачками.
На рис. 80 и 81 представлена часть типичного эксперимента, в котором электрод продвигался в поле 17 в направлении, близком к горизонтальному. В этом опыте точки фиксации двух глаз на экране не вполне совпадали (из-за наркоза и введения вещества, расслабляющего мышцы) — расстояние между ними составляло около 2°. Цветные круги на рис. 86 примерно соответствуют размерам рецептивных полей (около 1° в диаметре), расположенных в 4° ниже и слева от центральных ямок (регистрировались ответы клеток правого полушария). Первая клетка, отмеченная номером 96, была бинокулярной, однако для следующей, 114, явно доминирующим оказался правый глаз. Затем идут клетки под номерами от 111 до 118 с доминированием левого глаза. Легко заметить, как регулярно изменяется ориентация в последовательности клеток, в данном случае в направлении против часовой стрелки. Если построить график зависимости ориентации от продвижения электрода (рис. 87), то все точки лягут на линию, близкую к прямой. Переход от одного глаза к другому не сопровождался никакими резкими изменениями ни в направлении сдвига ориентации, ни в наклоне линии на графике. Согласно нашей интерпретации, это означает, что между двумя системами группировки — по глазодоминантности и по ориентации стимула — нет тесной связи. Это выглядит так, как если бы кора размечалась двумя совершенно независимыми способами.
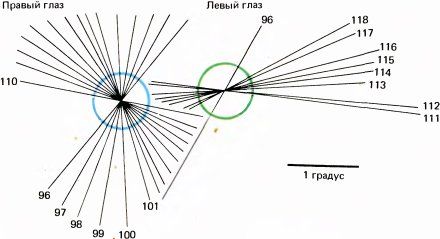 |
Рис. 80. Если ввести микроэлектрод в поле 17 коры макака очень наклонно, выявляется весьма регулярное изменение ориентационной избирательности (в данном случае исследованы 23 соседние клетки).
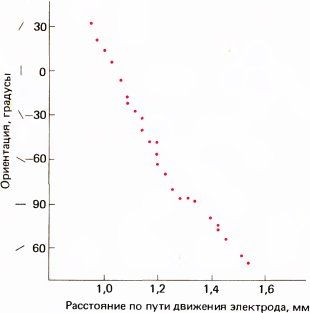 |
Рис. 81. Графическое представление результатов, отображенных на рис. 80. Это график зависимости оптимальной ориентации стимула (в угловых градусах) от расстояния, пройденного микроэлектродом. (Поскольку электрод вводился почти параллельно поверхности коры, длина проходки почти такая же, как соответствующее расстояние на поверхности коры). В этом эксперименте полный поворот ориентации стимула на 180° происходил на пути в 0,7 мм.
Когда электрод продвигается параллельно поверхности коры, оптимальная ориентация стимула может изменяться либо по часовой стрелке, либо в обратном направлении. В большинстве случаев при достаточно длинном пути электрода направление сдвига ориентации рано или поздно меняется на обратное. Момент такой смены, или реверсии, непредсказуем, но обычно она происходит с интервалами в несколько миллиметров. На рис. 82 приведен пример таких последовательных смен направления.
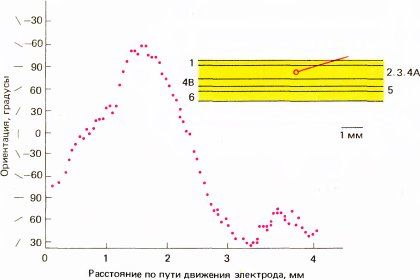 |
Рис. 82. Результаты еще одного эксперимента, представленные в виде графика зависимости оптимальной ориентации стимула от расстояния, пройденного электродом. Видны три точки реверсии, в интервалах между которыми сохраняется прямая пропорциональность.
Наконец, в некоторых экспериментах мы обнаружили еще одну особенность, которую назвали
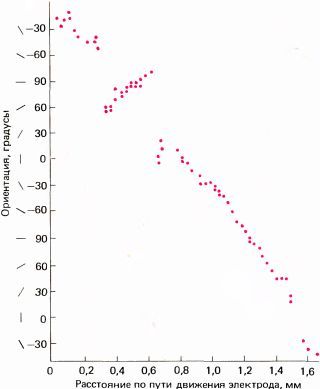 |
Рис. 83. Случай появления двух разрывов, т.е. точек, в которых оптимальная ориентация внезапно изменяется. До и после этих точек наблюдается плавное изменение оптимальной ориентации.
Как выглядели бы участки постоянной ориентации при взгляде на кору сверху? Ответить на этот вопрос оказалось гораздо труднее, чем на аналогичный вопрос о колонках глазодоминантности. Вплоть до самого последнего времени мы не имели прямой возможности «видеть» ориентационные группировки и могли лишь попытаться логически вывести их форму из результатов микроэлектродных исследований вроде описанных выше. Наличие как реверсий, так и разрывов наводит на мысль о сложности интересующей нас конфигурации. С другой стороны, линейная регулярность, которую мы наблюдали часто миллиметр за миллиметром вдоль коры, может означать периодичность, по крайней мере в пределах небольших зон коры; тогда реверсии и разрывы могли бы указывать на то, что эта периодичность прерывается через каждые несколько миллиметров.
В тех областях, где периодичность сохраняется, можно с определенной вероятностью реконструировать искомую конфигурацию. Предположим, эта конфигурация такова, что в пределах данной области при продвижении электрода параллельно поверхности коры мы наблюдаем периодичность без реверсий и разрывов, т.е. везде получаем такой график, как на рис. 81. Если бы мы имели достаточное число таких графиков, то смогли бы реконструировать трехмерную структуру (рис. 84); здесь вертикальная ось
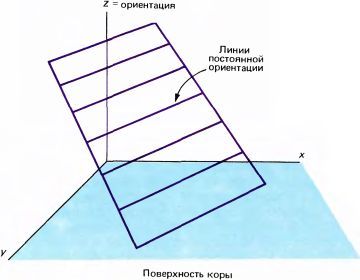 |
Рис. 84. Трехмерное представление, где поверхность коры расположена в плоскости
Если наши рассуждения правильны, то при выполнении множества произвольных проходок некоторые из них случайно будут совпадать с направлением ориентационных изолиний, и тогда ориентация должна оставаться неизменной. Такое действительно случается, но не очень часто. Этого и следовало ожидать, так как тригонометрия подсказывает, что даже небольшое отклонение направления проходки от изолинии должно приводить к довольно большим изменениям в ориентации; поэтому лишь в очень немногих случаях графики зависимости ориентации от глубины введения электрода могут оказаться горизонтальными линиями.
Число градаций ориентации, представленных в одном квадратном миллиметре коры, можно определить по наиболее крутым графикам, получаемым в эксперименте. Эта цифра составляет примерно 400 градусов на 1 мм, откуда следует, что полный набор ориентаций в пределах 180 градусов может содержаться на участке длиной около 0,5 мм. Эту величину нужно будет вспомнить, когда мы вернемся к вопросу о топографии коры и ее удивительной однородности. Однако, забегая вперед, хочу отметить, что толщина пары колонок глазодоминантности составляет примерно 0,4 + 0,4 мм, т.е. близка к 1 мм. Это вдвое больше толщины полного набора ориентационных пластин, однако порядок величины тот же.
Вскоре, однако, мы воспользовались методом картирования с помощью дезоксиглюкозы, который позволил непосредственно изучать геометрию ориентационных колонок. Для этого в качестве стимула мы взяли просто рисунок из параллельных полос с неизменной ориентацией, скажем вертикальной, который предъявляли на протяжении всего эксперимента. Полученная при этом картина (рис. 85) оказалась гораздо более сложной, чем картина колонок глазодоминантности. Однако и здесь отчетливо была видна регулярность распределения с периодом 1 мм или чуть меньше (расстояние от середины одной темной полосы до середины следующей). Это согласуется с электрофизиологическими данными (с тем расстоянием, на которое нужно передвинуть электрод от клеток с определенной ориентацией, скажем вертикальной, чтобы через все промежуточные варианты снова дойти до вертикальной ориентации). В некоторых местах мы находили структуру в виде правильных полос на площади в несколько квадратных миллиметров. Мы задавались вопросом: нет ли какой-то связи между конфигурациями ориентационных полос и полос глазодоминантности — может быть, например, они идут параллельно или же пересекаются под прямым углом? В том же самом эксперименте нам удалось выявить глазодоминантные колонки, после того как в глаз животного была введена радиоактивная аминокислота, а затем полученные срезы ткани анализировались с помощью двух методик (результат показан на рис. 86). Мы не смогли обнаружить никакой явной корреляции. Сравнивая сложную картину ориентационных колонок с гораздо более простым распределением колонок глазодоминантности, очень трудно было решить, какая
 |
Рис. 85. После инъекции дезоксиглюкозы наркотизированной обезьяне предъявлялся стимул в виде медленно движущихся черных и белых полос. На полученном радиоавтографе можно видеть периодическое распределение метки, в частности в слоях 5 и 6 (обширная область слева от центра). Круглое пятно, расположенное еще дальше влево, обусловлено равномерным распределением метки и соответствует слою 4Cβ; этого и следовало ожидать, поскольку клетки в этом слое нечувствительны к ориентации.
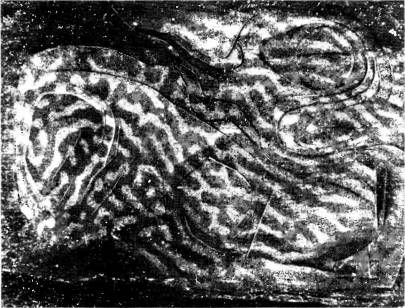 |
Рис. 86. Тому же животному, что и в предыдущем случае, в глаз неделей раньше была введена радиоактивная аминокислота (пролин). После промывания среза в воде с целью растворить 2-дезоксиглюкозу был получен радиоавтограф. Радиоактивная метка выявляет здесь колонки глазодоминантности. Эти колонки не имеют никакой видимой связи с ориентационными колонками.
У метода с применением дезоксиглюкозы есть один серьезный недостаток: никогда нет полной уверенности в том, что полученная картина распределения действительно связана с интересующим нас свойством стимула. Например, когда в качестве стимула используется рисунок из черных и белых вертикальных полос, как можно убедиться, что получившееся распределение связано именно с ориентацией этих полос, т.е. что в темных областях находятся клетки, отвечающие на вертикальные линии, а в светлых — клетки, которые на них не реагируют? Ведь вместо этого решающей особенностью данного стимула могло бы быть то, что он черно-белый, а не цветной, или же то, что он состоит из широких, а не узких полос, или, наконец, то, что экран расположен именно на таком, а не ином расстоянии от животного. Одно из косвенных подтверждений того, что действие дезоксиглюкозы затрагивает механизмы настройки на ориентацию, — это отсутствие каких-либо пятен или полос в слое 4C, где клетки не обладают избирательностью к ориентации. Другим подтверждением служит результат, полученный в исследованиях М. Страйкера из Калифорнийского университета в Сан-Франциско. Страйкер делал протяженные проходки микроэлектродом в стриарной коре кошек параллельно ее поверхности и каждый раз, когда встречались клетки с определенной оптимальной ориентацией, производил локальное разрушение ткани; затем после инъекции радиоактивной дезоксиглюкозы включался стимул с полосками одинаковой ориентации. В этих экспериментах была обнаружена явная корреляция между получаемым распределением метки на гистологическом срезе и ориентацией стимула.
Наиболее четко удалось недавно выявить ориентационные колонки с помощью красителей, чувствительных к электрическому напряжению, которые в течение многих лет разрабатывал Л. Коэн в Йеле. Г. Блэсдел из Питтсбургского университета применил их при исследовании коры головного мозга. При использовании этого метода краситель, чувствительный к напряжению и окрашивающий клеточные мембраны, наносят на поверхность коры наркотизированного животного, и нервные клетки поглощают его. Когда в эксперименте животному предъявляют стимул, все реагирующие на него клетки изменяют свой цвет. Если в области, близкой к поверхности коры, таких клеток окажется достаточно много, эти изменения цвета можно уловить с помощью современных методов обработки телевизионных изображений. Хотя изменения цвета едва заметны, с помощью чувствительных телекамер и машинных методов фильтрации шумов их можно обнаружить. Блэсдел использовал в своих опытах стимуляцию полосами определенной ориентации, после чего фотографировал полученное распределение активности клеток на участке площадью в несколько квадратных сантиметров. Затем та же процедура повторялась при многих других ориентациях стимула. После этого каждой ориентации был поставлен в соответствие свой цвет — красный для вертикальной, оранжевый для положения часовой стрелки в 1 час и т.д.; потом все изображения были наложены друг на друга. Поскольку изоориентационная линия должна постепенно смещаться по мере изменения ориентации, в любой небольшой зоне изображения должен возникнуть радужный узор. Именно это и обнаружил Блэсдел в действительности. Примеров успешного применения этого метода пока еще мало, и нет возможности интерпретировать получаемые изображения в таких понятиях, как разрывы и реверсии, однако метод представляется многообещающим.
 |
Рис. 87. В этом эксперименте Г. Блэсдел использовал для обработки стриарной коры обезьяны окрашивание, чувствительное к электрическому напряжению. Обезьяне предъявлялись полосы последовательно изменяющейся ориентации. Изображение коры было получено с помощью телевизионной техники. С помощью компьютерной обработки изображений было получено окончательное изображение, на котором участкам, реагирующим на ту или иную ориентацию стимула, был приписан определенный цвет. В любой небольшой области коры ориентационные зоны проявляются в виде параллельных полос, так что в целом полный набор элементов, настроенных на разные ориентации, дает картину, окрашенную во все цвета радуги.
Теперь, когда мы узнали кое-что о топографическом представлении в коре параметров ориентации и глазодоминантности, мы можем рассмотреть взаимосвязь между этими отображениями и проекциями зрительных полей. Обычно говорят, что сетчатка отображается на кору взаимно однозначно. Однако, учитывая то, что нам известно о рецептивных полях корковых клеток, можно с уверенностью сказать, что это утверждение, строго говоря, неверно, поскольку каждая клетка получает входные сигналы от тысяч палочек и колбочек, а ее рецептивное поле — далеко не точка. Отображение сетчатки на кору гораздо более сложно, чем любое обычное взаимно однозначное отображение. На рис. 88 я попытался показать распределение в коре тех областей, которые активируются под действием простого стимула (не следует смешивать это с рецептивным полем одиночного нейрона). Стимул здесь — это короткий отрезок линии с наклоном в 60° относительно вертикали, предъявленный только левому глазу. Мы предполагаем, что этот элемент поля зрения проецируется на область коры, выделенную прямоугольником с закругленными углами. В пределах этой области будут возбуждены только те полосы, которые связаны с левым глазом, а в этих полосах — только те участки, которые соответствуют ориентации в 60°. Все они на рисунке зачернены. Таким образом, линия, появившаяся в поле зрения, вызывает причудливую картину распределения возбужденных клеток коры в виде ряда узких полосок.
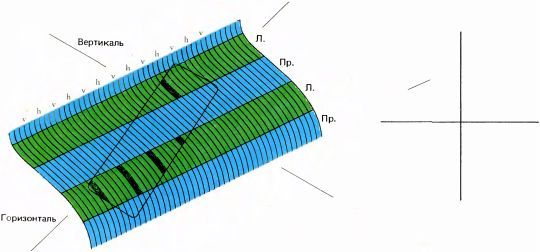 |
Рис. 88. Наклонный отрезок прямой, предъявленный левому глазу (справа), мог бы вызывать распределение возбуждения в небольшой зоне стриарной коры, показанное слева. Возбужденные участки будут ограничены небольшой зоной коры — длинной и узкой в соответствии с формой стимула. В пределах само́й этой зоны возбуждение ограничено колонками глазодоминантности для левого глаза и только теми ориентационными колонками, которые соответствуют ориентации часовой стрелки в 2.00 или 8.00. Как видно, корковое отображение данного стимула не так просто!
Теперь становится понятно, насколько наивно представление о зеленом гомункулюсе, который сидит у нас в голове и рассматривает передаваемую в кору картину. На самом деле картина, которая создается в коре, имеет примерно такое же отношение к изображению внешнего мира, как электрические процессы в телекамере — к передаваемой внешней сцене. Если бы распределение корковой активности точно воспроизводило распределение яркости в поле зрения, то это означало бы, что на пути от сетчатки в кору не произошло ничего существенного. В этом случае действительно потребовался бы маленький зеленый человечек.
Вряд ли можно представить себе, что в процессе эволюции было затрачено столько усилий на столь изящную группировку клеток в двух взаимонезависимых системах колонок, если бы это не обеспечивало какой-то пользы для животного. Пока мы не докопаемся до точной схемы связей, определяющей отображение сетчатки в коре, мы вряд ли сможем до конца понять принципы группировки клеток в коре. Сейчас мы можем только строить логичные догадки. Если мы предположим, что схема, приведенная в главе 4, соответствует реальности, то придется признать: то, что нужно для перехода от простых клеток к сложным или для создания чувствительности к концам линий или к направлению движения, — это определенного рода конвергенция множества клеток на одну клетку, причем у рецептивных полей промежуточных клеток должна быть одна и та же ориентация и примерно одно и то же положение. Пока у нас не было особых оснований предполагать, что клетка с определенной ориентацией рецептивного поля получает входы от клеток с рецептивными полями иной ориентации. (Я здесь несколько преувеличиваю: высказывались предположения, что клетки с разной оптимальной ориентацией стимулов могут быть соединены тормозными связями; в пользу этого имеются лишь косвенные данные, на мой взгляд, не очень убедительные, хотя их нельзя игнорировать.) Если это так, то почему бы не группировать вместе клетки, которые должны быть взаимно связаны? Альтернативный вариант едва ли целесообразен — легко представить себе, как трудно было бы обеспечить надлежащие связи между клетками, если эти клетки разбросаны в коре без учета их сходных свойств! Особенно много связей должно быть между клетками с одинаковой оптимальной ориентацией, и если бы такие клетки распределялись случайным образом, то сеть аксонов, необходимых для их соединения, заполнила бы все пространство между нейронами. Как бы то ни было, фактически они группируются вместе. Изложенные соображения относятся и к клеткам, сходным по глазодоминантности.
Но если клетки со сходными свойствами упаковываются вместе, то почему, продвигая электрод, мы наблюдаем последовательное изменение ориентации небольшими шагами? И чем объясняется цикличность — почему, пройдя все возможные варианты, мы опять возвращаемся к исходной ориентации, а потом весь цикл повторяется снова? Казалось бы, можно было собрать вместе все клетки с ориентацией 30°, все клетки с ориентацией 42° и т.д.; и наконец, объединить все клетки с доминированием левого глаза и все — с доминированием правого глаза. Если бы мы знали, как устроена кора, то смогли бы предложить много ответов на эти вопросы. Сейчас выскажем одно предположение: возможно, что клетки с разной ориентацией действительно оказывают тормозящее воздействие друг на друга. Если нежелательно, чтобы какая-то клетка отвечала на другие ориентации, отличные от ее собственной, то нетрудно представить себе наличие тормозных связей, которые обостряют настройку данной клетки на определенную ориентацию. Тогда наблюдаемая картина — как раз то, что нам нужно: клетки с одинаковой ориентацией расположены ближе всего друг к другу, но не слишком далеко от клеток с иной, но очень сходной ориентацией; тогда тормозные связи будут достаточно короткими. Возможно другое предположение: если рассмотреть, какие входы от клеток слоя 4 (с круглыми полями) нужны для организации простой клетки с определенной оптимальной ориентацией, легко увидеть, что потребуется лишь небольшое изменение набора входов для того, чтобы получить близко расположенную простую клетку с близкой, но несколько иной ориентацией. Для этого достаточно добавить несколько новых входов, а несколько прежних убрать (рис. 89). Такого рода соображения позволили бы объяснить физическую близость расположения клеток со сходной ориентацией.
Предметом следующей главы будет взаимосвязь между ориентацией, глазодоминантностью и проекцией поля зрения на кору. Рассмотрение этого вопроса может помочь нам понять, почему нужно так много колонок. Когда к этому добавится еще вопрос о топографии, соответствующая корковая организация будет представляться еще более сложной и интересной.
 |
Рис. 89. Показана группа клеток слоя 4 с концентрическими рецептивными полями, необходимая для создания простой клетки, отвечающей на наклонную линию с ориентацией «4.00 — 10.00». Вероятно, эта группа имеет общие клетки с группой, необходимой для реакции на линию с ориентацией «4.30 — 10.30», — для превращения одной группы в другую достаточно лишь несколько связей убрать, а несколько добавить.
| © 2024 Библиотека RealLib.org (support [a t] reallib.org) |